冠微小循環障害について
表1に、CreaとCamiciが提案した冠微小循環障害の分類を示します。Type 1が、冠微小血管に原因があり、心筋疾患や閉塞性冠動脈疾患と伴わないものです。「微小血管狭心症」はここに分類されます。Type 2は心筋疾患、Type 3は閉塞性冠動脈疾患に併発するもので、まだ、その実態は多くが解明されていません。Type 4は医原性のもので、冠動脈インターベンション等に伴い生じているものです。これについても詳細はまだ解明されていません。本研究会では、Type 1をまず研究していきますが、Type 2~4についても、今後、解明していく予定です。
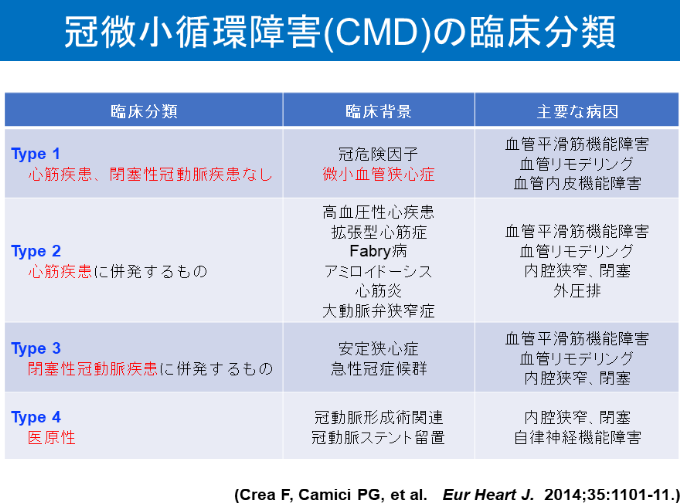
表1 冠微小循環障害(CMD)の臨床分類
狭心症症状を有し、非侵襲的検査で虚血所見が認められるにもかかわらず、冠動脈造影で冠動脈に狭窄病変を認めない病態をINOCA(ischemia with non-obstructive coronary arteries)と呼び、近年注目されています。INOCAには冠攣縮と冠微小血管障害の2つの病態が関与していると考えられていますが、冠攣縮に関しては、早朝や過換気時の胸痛など、冠攣縮を疑わせる症状がある場合には冠動脈造影を実施し、アセチルコリンやエルゴノビンによる冠攣縮誘発試験で確定診断することができます。冠微小循環障害による狭心症の診断については、診断基準が本研究会代表の下川教授が設立メンバーの一人である国際研究組織Coronary Vasomotion Disorders International Study Group (COVADIS)により発表されています(表2;文献8)。それによると、心筋虚血による症状・非閉塞性冠動脈疾患・心筋虚血の証明に加え、冠微小血管機能障害の存在が診断要件として示されています。太い冠動脈の攣縮と微小循環障害の合併頻度については東北大学より報告()されており、INOCAを疑った187例のうち、128例(68%)が太い冠動脈の攣縮であり、22例(12%)が微小血管攣縮と診断されました。またCFRの低下が66例(35%)、IMRの上昇が70例(37%)に認められ、84例(45%)の症例では冠動脈機能異常のうち2つ以上を合併していました(図7)。
以上より、狭心症を疑い、心臓カテーテル検査を実施しても狭心症を説明できる太い冠動脈の器質的な狭窄が認められない場合、症状の原因を早急に心臓以外と判断することは、適切な診断や治療が行われないリスクを生じさせます。

INOCAには冠微小循環障害が関与している可能性があることを常に念頭に置いておく必要があります。
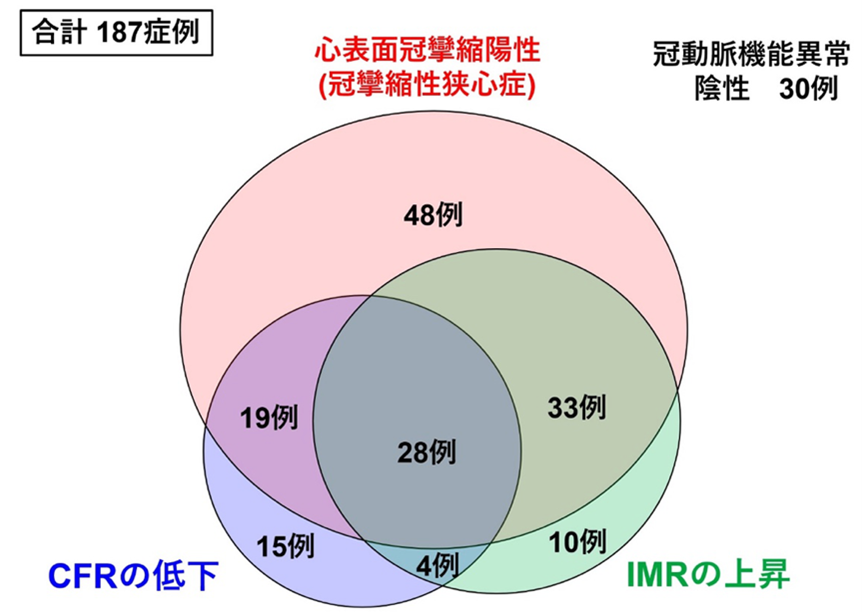
図7 冠動脈機能異常の合併(文献6より改変引用): 狭心症を疑い冠動脈造影を行なった結果、器質的冠動脈狭窄を認めなかった187症例のうち、アセチルコリン負荷試験により128例(68%)が心表面冠攣縮と診断された。また冠動脈拡張障害の評価では、CFRの低下が見られた症例が66例(35%)、IMRの上昇が見られた症例が70例(37%)であり、84例(45%)では心表面冠攣縮、CFR低下、IMR上昇の冠動脈機能異常のうち2つ以上を合併していた。
心電図変化,症状ならびに心筋逸脱酵素(トロポニン)上昇等から臨床的には急性心筋梗塞と診断される症例のうち、約6%の症例が冠動脈造影で冠動脈に有意な閉塞性病変が認められなかったと報告されています(文献9)。そのような病態をMINOCA(myocardial infarction with non-obstructive coronary arteries)と呼びます。MINOCAの診断のためには、虚血以外の心筋障害を来す病態(例:心筋炎,たこつぼ心筋症等)を除外しなければなりません。MINOCAを疑った場合には、まず非虚血性の心筋障害の可能性がないかどうかを考え、続いてトロポニン上昇を引き起こす他の病態(肺塞栓、敗血症など)の関与がないかどうか吟味します。さらに冠動脈造影で有意狭窄はなくとも、①プラークの破綻が起こっていることがあり、血管内イメージング(OCTやIVUS)を併用することで不安定プラークを描出できることがありますし、②冠攣縮誘発試験ならびにCFR、IMR測定を行うことにより冠攣縮や微小血管障害などの虚血機序が明らかとなり、MINOCAの原因を特定できることがあります。MINOCAの原因を特定することは重要で、プラーク破綻であることが判明すれば抗血栓療法やスタチン、冠攣縮であればカルシウム拮抗薬等、個々の症例ごとに適切な治療選択が可能となります。MINOCAの原因として、冠微小循環障害を考慮することは重要であり、海外の報告では、MINOCA症例連続80例に急性期に冠攣縮誘発試験を施行したところ、46%の症例で陽性所見が得られましたが、そのうち65%が太い冠動脈の攣縮であり、35%が微小血管攣縮でした(文献10)。
たこつぼ心筋症とは、左心室心尖部を中心としたびまん性壁運動低下とそれを代償する心基部の過収縮をきたし、その形態より「たこつぼ」と呼称される疾患です。一般的には可逆的で予後良好な疾患として理解されていますが、心破裂や致死的不整脈の発生など、重篤な合併症の報告もあります。現在、たこつぼ心筋症の成因として、1.冠動脈の多枝攣縮、2.冠微小血管攣縮、3.カテコラミンによる心筋障害などの機序が考えられていますが、1つの成因のみではなく、これらの病態が併存していると考えられます。たこつぼ心筋症の症例で急性期に冠動脈造影を行うと、太い冠動脈に有意狭窄を認めなくとも造影遅延の所見を認めることがあり、冠微小循環障害が示唆されることがあります。その背景には、交感神経の過緊張、微小血管攣縮、酸化ストレスなどの存在が疑われます。本疾患の発症メカニズムについては、不明の点が数多く残されていますので、今後、実臨床においてCFR、IMR測定などにより冠微小循環を評価したたこつぼ心筋症の症例を蓄積し検討する必要があります。
冠微小循環障害は駆出率が保たれた心不全(HFpEF)の病態にも深くかかわっていると考えられています。微小循環障害を反映するCFR(冠血流予備能)とHFpEFとの関連性についての報告は少ないのですが、Eur Heart J 2018;39:840-849(文献11)の研究では、HFpEF連続201例のCFRを測定しており、CFR低下群(CFR<2、n=108)はCFR正常群に比し予後不良で、CFR値は組織ドップラー法によるe`と正の相関を、E/e`とは負の相関を示しました。多変量解析でCFR低下は拡張障害に関与し、複合心血管アウトカム・HFpEF入院とも相関が認められました。CFR低下と拡張障害(E/e`>15)を併せ持つとHFpEFによる心不全入院のリスクが5倍以上になることが示されました(図8)。この研究から、冠微小循環障害はHFpEFの病態と予後に密接に関与することが明らかとなりました。
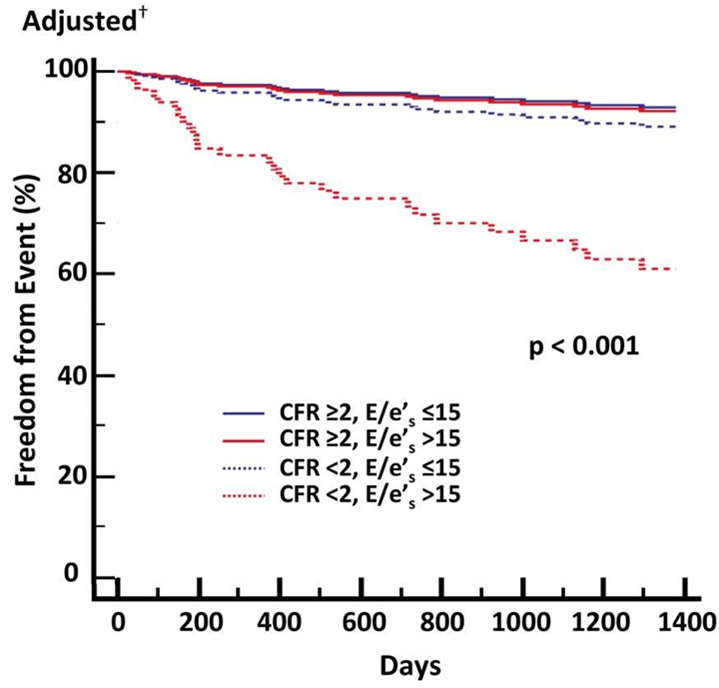
図8 HFpEF患者のCFR・心筋拡張障害有無別の予後(文献11より引用): CFR低下(2未満)と拡張障害(E/e`>15)を併せ持つとHFpEFによる心不全入院のリスクが5倍以上になることが示された。
参考文献
6)J Am Coll Cardiol 2019;74(19):2350-60
8)nt J of Cardiol 2018;250:16 -20
9)Circulation 2015;131:861-70
10)Eur Heart J 2018;39:91-98
11)Eur Heart J 2018;39:840-849
© 2022 日本冠微小循環障害研究会